血液循环肿瘤细胞(Circulating Tumor Cells, CTC)是指进入到血液循环中的肿瘤细胞。部分CTC可以逃离机体免疫识别或药物治疗,在体内寻找合适的微环境,形成“种子”在远端组织器官或原发组织种植生长,造成肿瘤的转移或复发。CTC检查是测定血液中流动癌细胞的一种检查。通过CTC检查能够识别出影像检无法发现的超早期微小癌,临床上能够比以往传统的诊断方法更早的发现肿瘤,能得知超早期的原发癌发病率,以及超早期的癌症转移或复发。肺癌、直肠癌、乳腺癌、前列腺癌、胰腺癌等肿瘤患者CTC是血中观察肿瘤预后治疗效果的重要生物标记物。肿瘤病人血中CTC数目越多,病人的预后越差。
CTC与肿瘤的生长和转移
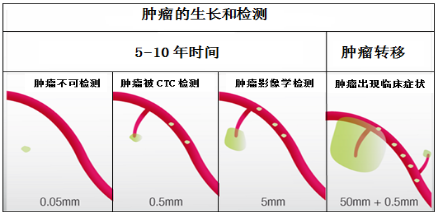
T≤ 0.05mm:血液循环中无CTC,肿瘤不可被检测出;
T ≥ 0.5mm:血液循环中出现CTC,肿瘤仍然不能被影像学检测出;
T ≥ 5mm:血液循环中出现CTC,肿瘤可以被影像学检测出;肿瘤的细胞数是109,~10亿个;
T ≥ 50mm:血液循环中大量出现CTC,肿瘤出现转移。
CTC的俘获
CTC基于俘获的原理有两大类,化学方法和物理方法。
化学方法
1) 化学方法主要是基于CTC是上皮细胞,大多数的上皮细胞的表面有一些特异的抗原标记物如EpCAM, Cytokeratins等,利用外来的抗体与抗原的结合就可以把CTC从血液中分离出来。基于抗体的载体的不同,又有一些不同的分类。
a) 一类是抗体涂在固定的表面如微柱或者微腔如微流体控的装置-通过增大抗原和抗体接触面积来增加CTC的俘获。
b) 另一类是抗体涂在流动的表面如磁珠,通过外加的磁性引力来达到纯化和富集的目的。如通过FDA的Cellsearch®或国内类似的产品。
2) 化学方法根据CD45的表达又分为阳性和阴性两种方法。这是基于CTC等上皮细胞不表达CD45。他们都利用了CTC不表达CD45的特点,把白细胞去掉。
3) 基于抗原和抗体的化学方法无论载体如何改变都无法克服技术本身的缺点:
a) 抗原与抗体的结合容易致CTC的凋亡,使得俘获的CTC数目减少。这点已经被证实,这也是Cellsearch®虽然通过FDA的批准但在临床上得不到应用的主要原因之一。
c) 不能俘获EMT细胞-即从上皮到间质转化的细胞,这类细胞不表达传统的上皮细胞表面抗原标记物,所以不被抗体识别和俘获。这类细胞恶性度最大,是肿瘤转移的元凶。血液中有EMT细胞即表示患者预后不好。
物理方法
物理方法是根据细胞的形态大小和密度的不同。根据形态大小的不同是主流。这类方法简便,不易致CTC的凋亡,也能俘获EMT细胞。第一代的产品存在CTC的俘获纯度低的缺点,是由于膜自身的缺点引起的。俘获后的CTC可以用于下游一系列的检测,如FISH检测染色体重组,免疫组织化学的CTC分型,CTC的基因测序,荧光定量基因表达水平的改变,细胞培养用于抗肿瘤的药物敏感试验和新的抗肿瘤药物的开发。
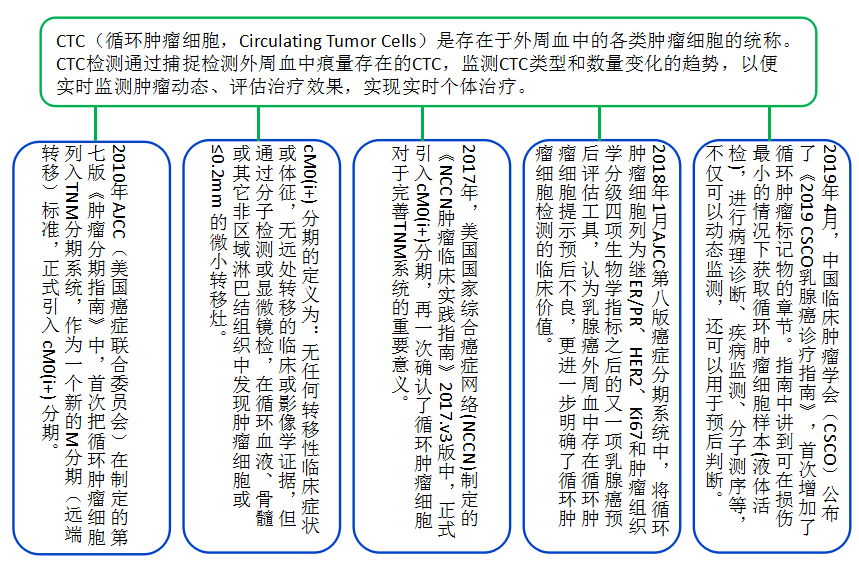
CTC在临床中的主要应用
液态活检是一种非侵入式、多次式的血液检测方式。与传统的固态活检相比,液态活检采集患者5~10ml 血液,采样方便,且涵盖了健康人的早期肿瘤筛查、后期肿瘤患者靶向用药治疗和预后,优势明显。液态活检主要涉及CtDNA和CTC。
CtDNA:是指来源于血液中肿瘤细胞即CTC释放的DNA。它是血中肿瘤细胞凋亡后释放出的小分子片段的DNA。肿瘤细胞的凋亡是不同于死亡的一种生物学过程。多种外在因素的刺激启动了细胞内部细胞凋亡途径而发生的。有文献报道肿瘤患者手术后 ctDNA显著性的下降,这给检测技术提出了更高的要求。当血液中的ctDNA含量低时,就需要检测灵敏度更高的技术,该技术能够区分微小的基因突变信号和背景信号。因此,ctDNA检测面临着开发出高灵敏度的基因突变检测技术的难点。
cfDNA:是指血液中无细胞的DNA。它主要来源于血液中凋亡的白细胞,只有很少的一部分来源于血中的肿瘤细胞,仅占<0.01%。来源于白细胞的DNA不带有任何肿瘤的信息,在肿瘤的液态活检中没有的意义。但白细胞的克隆性造血现象会造成大量的基于CtDNA的基因突变检测结果的假阳性,把肿瘤的精准治疗引向危险的境界。
意义不明的克隆性造血(Clonal hematopoiesis of indeterminate potential, CHIP )是指由一个造血干细胞或者其他早期的起始血细胞为了更好的适应环境而发展成一个带有一些基因变异的亚型。这个亚型带有基因变异一般是非驱动性的,而且该亚型占血细胞的比率跟年龄有很大的相关性。克隆性造血可以分为两种情况,一种是正常人因机体老化出现克隆性造血,另一种是白血病患者治疗后长期生存或无病状态下的克隆性造血。
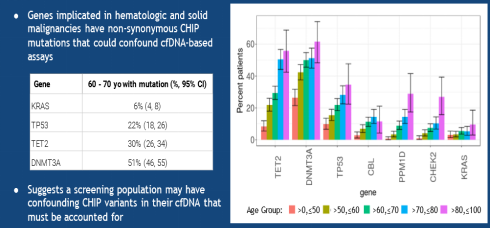
1) 研究表明,40岁以下的该亚型的比率只有少于1%,而超过70岁的,可能比率会高达10%~20%。
2) 在做cfDNA检测中,如果在抽提cfDNA时,没有将白细胞完全清楚干净,那么带有白细胞的cfDNA的检测结果可能会出现几十个低频的非驱动性变异,一般频率会低于5%。
3) 随着ctDNA检测技术的不断发展,越来越多研究者开始关注意义未明的克隆性造血(CHIP)现象,即在白细胞小克隆群体中癌症相关基因的突变累积。无论是进行组织测序还是液态活检,CHIP的危害在于这些克隆突变可能被误认为是体细胞突变,进而在肿瘤组织测序后导致患者接受错误治疗,或引起癌症液体活检结果的假阳性。
4) 美国GRAIL 公司CCGA的研究结果显示在这项研究中,对肺癌患者的检测中超过54%的体细胞突变都是来源于白细胞,而不是肿瘤。在1400多个CCGA样本中(576个对照样本和836个患者样本),7%的样本中表现出变异等位基因频率超过10%的克隆造血现象,约40%的样本具有的VAF(Variant Allele Frequency) 频率低于1%。更重要的是,克隆造血的VAF频率在癌症样本和非癌症样本中是相似的。在鉴定到的CHIP变异中,超过90%都是个体特异性的。这意味着,在癌症液体活检方法中,并没有某种生物信息学工具或其他捷径可以解决克隆造血的干扰。
5) CCGA的数据结果同时表明避免假阳性事件在cfDNA筛查中的必要性。
CTC在临床应用上的优势
Chemi F等通过对100位早期非小细胞肺癌患者的研究发现(Nat Med 25, 1534–1539 ,2019)早期肺癌患者手术时的肺静脉CTC(PV-CTC)能有效预测手术后的生存和复发情况。更值得关注的是,研究者运用高通量测序技术对肿瘤组织(原发灶多个部位、转移灶)和液体活检标本(CTC和cfDNA)进行基因分析,并分别对比了ctDNA、CTC与原发肿瘤、转移病灶间的信息一致性,旨在揭示肿瘤演化轨迹,探寻转移发生的分子机制,为临床如何干预能有效降低肺癌复发率,预防转移提供研究基础。结果发现:
(一) 肺癌早期的CTC比cfDNA携带更全面的肿瘤基因信息
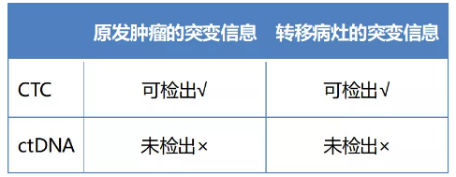
肺癌早期CTC和ctDNA能否携带全面的肿瘤实时生物学信息,直接影响其在液体活检领
域的发展前景。本研究充分证实了CTC在全面反映肿瘤生物学信息中的独特优势。
(二) 肺癌早期CTC与10个月后转移灶基因突变一致性达到91%
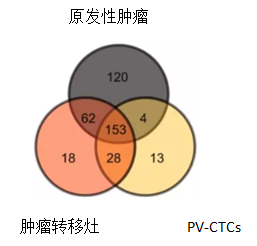
肺癌早期PV-CTC91%的突变可在10个月后发生的转移灶组织中检出(181/198),而在原发灶该比例只有79%(157/198)。
(三) 肺癌早期CTC与转移灶属于同一肿瘤进化分支,是肺癌复发的直接原因
研究者通过系统的肿瘤进化生物学分析发现,肺癌早期CTC和转移灶属于同一特异的肿瘤进化分支,该分支与原发肿瘤截然不同。因此肺癌早期的CTC正是导致术后复发的直接原因。
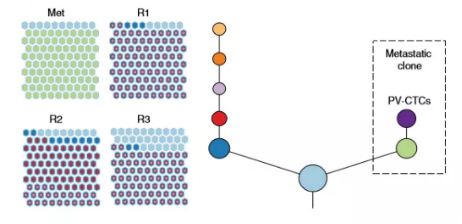
肿瘤早期CTC不仅能携带原发肿瘤的突变信息,也能携带数月后发生的转移灶突变信息,这提示了CTC在克服肿瘤时空异质性,提供肿瘤实时、全景基因突变谱的独特优势,CTC甚至为提前预知转移机制、明确遏制转移的治疗靶点、降低肺癌术后复发率方面,展现了巨大的应用潜能。



